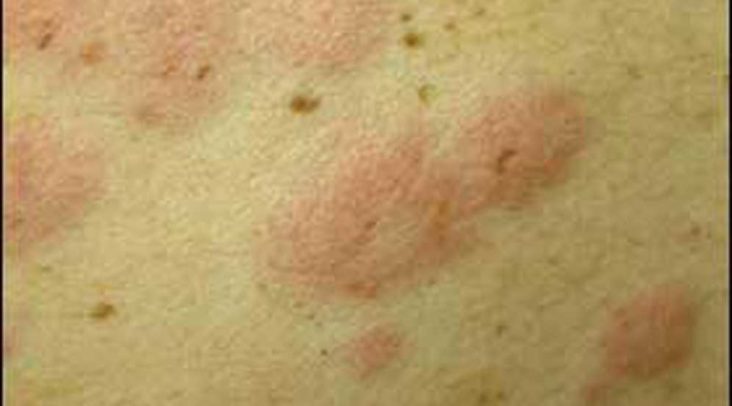
L’orticaria è una dermatosi molto comune, caratterizzata dall’eruzione più o meno diffusa, monomorfa di pomfi.
- Il pomfo è definito come un rilievo edematoso circoscritto, rotondeggiante o ameboide, con dimensioni che variano da pochi mm a diversi cm.
- Colore roseo-rosso in periferia e bianco opalino al centro
- Consistenza elastica
- Pruriginoso
Durata: transitoria (da pochi minuti a qualche ora).
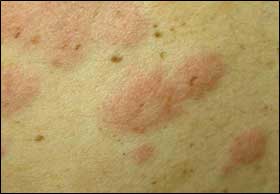
Classificazione delle orticarie
L’obiettività clinica da sola non consente di identificare i vari tipi di orticaria.
→Si utilizza un criterio cronologico per distinguere in modo convenzionale:
- una forma acuta, quando le lesioni permangono per meno di 6 settimane;
- una forma cronica, quando si manifesta per un periodo superiore a 6 sett.
→Si utilizza l’eziopatogenesi, per classificare i casi di orticaria in forme a causa:
- immunologica ed extraimmunologica.
Orticaria a patogenesi immunologica
Immunoreazioni di tipo I “secondo Gell e Coombs” – orticaria allergica
- IgE mediata
- Causata da: farmaci, alimenti, allergeni inalanti, parassiti, o puntura d’insetto
- Frequente in soggetti atopici
- La reazione comincia entro qualche minuto dall’esposizione della sostanza responsabile, ma possono anche trascorrere delle ore se l’allergene è alimentare
- Possibile lo sviluppo di shock anafilattico.
Immunoreazioni di tipo II “secondo Gell e Coombs”
- Reazioni trasfusionali
Immunoreazioni di tipo III “secondo Gell e Coombs”
- Vasculite
- Da infusione di siero eterologo
- In malattie autoimmuni
- Da infusioni di immunoglobuline
Autoimmune
- Autoanticorpi IgG rivolti contro diversi autoantigeni
- Autoanticorpi (IgG-1 e IgG-4, IgA, IgM)
- anti IgE (porzione Ce 2-4 della catena pesante)
- anti recettore ad alta affinità Fc-e-R1 per le IgE
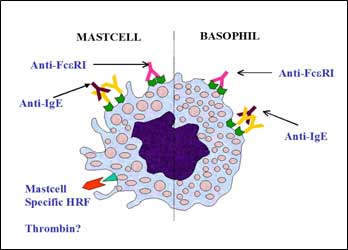
Orticaria a patogenesi immune non definita
- Da infezioni virali o batteriche
- Da parassiti
- In corso di neoplasie
Orticaria a patogenesi extraimmunologica
• Da sostanze istamino-liberatrici dirette
• Fisica
• Psicogena
• Da contatto
• Da altri fattori
LE SOSTANZE AD ATTIVITA’ ISTAMINO-LIBERATRICE SONO:
- Enzimi proteolitici: tripsina, papaina, chimotripsina
- Sostanze tensioattive sulle superfici cellulari
- Composti ad alto peso molecolare: destrano, polivinil-pirolidone
- Sostanze con due o più gruppi basici:
– chemioterapici
– Sostanze ad azione sul SNC: apomorfina, codeina, morfina
– Miorilassanti: curarina e suoi derivati
– Sostanze ad azione sul sist. Circolatorio: anfetamina, atropina, Idralazina
- Peptidi biologicamente attivi: anafilotossine, proteine presenti in veleni (serpenti, imenotteri)
- Sostanze come la tiramina contenute in vari alimenti: formaggi, fico, cioccolata
- Sostanze non chimicamente definite contenute in alimenti animali e vegetali:
aragoste, gamberi, cozze, fragole, agrumi.
ORTICARIA DA AGENTI FISICI
Caratteristiche cliniche:
- Estrema fugacità eruttiva (che non supera l’ora)
- Prurito intenso
Orticaria Dermografica
Si ha comparsa di pomfi eritematosi lineari in corrispondenza di aree sottoposte a stimoli fisici, quali: grattamento o sfregamento.
Si distingue in:
- Dermografismo semplice: il paziente è asintomatico e non necessita di alcuna terapia
- Dermografismo sintomatico: il paziente lamenta prurito
Quest’ultimo può essere:
– Immediato: compare entro 2-5 minuti → dura per 30 minuti
– Intermedio: compare tra 30 min-2 h → dura per 3-9 h
– Ritardato (raro): compare entro 4-6 h → dura per 24-48 h
Epidemiologia
E’ la forma più comune:
- incidenza 7-10% di tutte le orticarie croniche → fino al 17%, in studi effettuati in Germania. Zubierber et Al, J Am Acad Dermatol 1994
Patogenesi
Dermografismo primario: (da causa non nota)
- ipotizzata una sensibilizzazione IgE mediata dopo test di trasferimento passivo con plasma → prova di Praunitz-Kústner (PK).
- In alcuni pz è stato osservato l’incremento dei livelli di istamina nel plasma dopo stimolo fisico.
Dermografismo secondario: si distingue in:
- Forme transitorie: osservate durante episodio di orticaria acuta, ® dopo assunzione di farmaci (penicillina, ASA, codeina, famotidina, lidocaina),
→ scabbia e infestazioni parassitarie, → punture di insetto.
- Forme persistenti: nel corso di mastocitosi cutanea.
Kontou-Fili et Al, Allergy 1997 Phisical Urticaria: Classification and diagnosis guidelines
Diagnostica dell’orticaria Dermografica
Si può utilizzare un “dermografometro” a pressione controllata o lo stesso oggetto che ha provocato la lesione. Controllo: a 5’- 30’- 2 h ® per le forme ritardate a 4-6 h
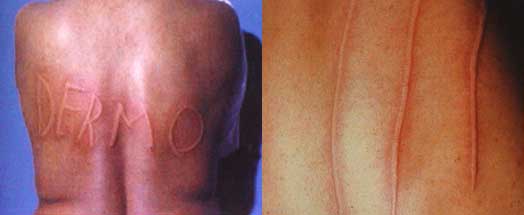
Orticaria dermografica
Orticaria da freddo
- Nel 97% dei casi è idiopatica
- Può essere ereditaria (a trasmissione autosomica dominante)
- Piccoli pomfi eritematosi, scarsamente pruriginosi, che si presentano 1-2 ore dopo lo stimolo
- Può essere associata a sintomatologia sistemica (febbre, artralgie) e manifestazioni quali: crioglubulinemia, linfomi, leucemie, connettiviti.
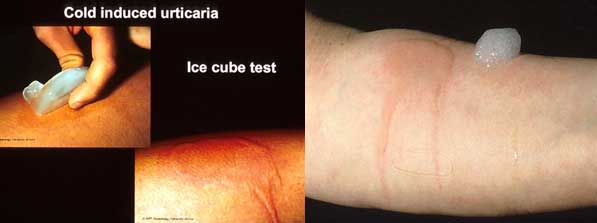
Orticaria da freddo
Orticaria da caldo o colinergica
È provocata da:
- Esercizio fisico sportivo
- Stress emotivo
- Ingestione di alimenti piccanti
Caratteristiche cliniche:
- Piccoli pomfi eritematosi (l’istamina viene liberata per azione diretta dell’acetilcolina)
- Prurito intenso
- Compaiono pochi minuti dal contatto con il fattore scatenante
- Persistono da pochi minuti a qualche ora
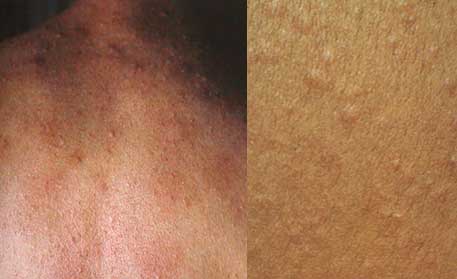
Orticaria da caldo o colinergica
Orticaria solare
- Insorge su zone foto-esposte, pochi minuti dopo l’esposizione solare e scompare rapidamente allontanandosi dal sole
Orticaria da pressione
- Condizione rara (2% ) di tutti i tipi di orticaria
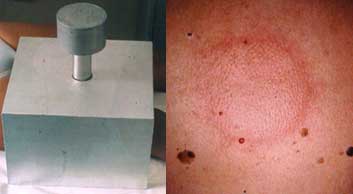
Orticaria da pressione
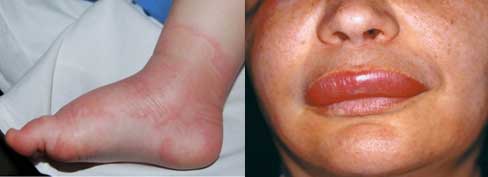
ANGIOEDEMA O EDEMA DI QUINCKE O ORTICARIA-ANGIOEDEMA
- L’angioedema è una importante e talora grave forma di orticaria, caratterizzata da un ampio e più profondo rilievo edematoso con meno eritema, a carico della cute e/o delle mucose con tessuto lasso: labbra, palpebre, apparato genitale, lingua e vie aeree superiori.
- Colpisce circa il 15-20% della popolazione
- F:M 2:1
- Età compresa tra i 30-40 aa (raro nell’infanzia e nell’età avanzata)
- Forme ereditarie (1 caso su 100.000 ab.).
- Forma ereditaria: grave malattia autosomica dominante, caratterizzata da episodi di angioedema del volto e degli arti, associata ad edema della mucosa orale e della laringe (possibili dolori addominali da angioedema della parete intestinale).
- Caratteristica fondamentale è il deficit di inibitore della C1 esterasi .
- L’angioedema è dovuto all’attivazione sinergica del sistema delle chinine e del complemento, che porta alla formazione incontrollata di peptidi ad azione edemigena diretta.
- Il C1 inibitore è una glicoproteina che, normalmente, esercita una azione inibitrice sulla prima frazione del complemento e sul fattore di Hagemann.
- Il deficit del C 1 inibitore può essere acquisito e si associa a malattie quali:
- Linfoma a cellule B, connettivite (LES).
ORTICARIA VASCULITE
- In questa forma di orticaria i pomfi non hanno un andamento transitorio, ma sono persistenti nella sede di comparsa e si associano con una notevole frequenza a macchie purpuriche.
- Queste lesioni persistono di regola 24-72 ore, talora per una settimana.
- Sono provocati da Immunocomplessi (IC) in eccesso di Antigene, che precipitano a livello dei piccoli vasi, (venule post-capillari).
- Sintomatologia: prurito, bruciore e dolore
- Esiti discromici possibili
- Possibile coinvolgimento sistemico (febbre, malessere, perdita di peso, artralgie, mialgie); interessamento specifico di organi (adenopatie, epato-splenomegalia, manifestazioni respiratorie, neurologiche, renali, oculari etc.).
Epidemiologia
- Interessa principalmente donne giovani o di media età, è eccezionale prima della pubertà.
- La sua frequenza in letteratura rappresenterebbe sec. Clive Grattan – J. Am. Acad. Dermatol 2002; il 5% delle forme di orticaria cronica.
- L’evoluzione è cronico-recidivante
- Si manifesta come forma idiopatica, ma spesso è associata ad altre affezioni: Connettivopatie, Infezioni (Epatite B), Neoplasie.
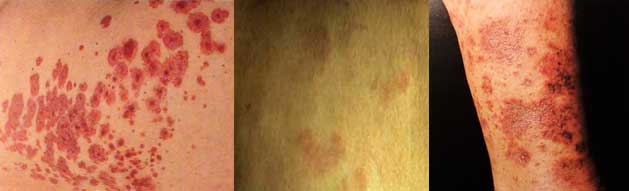
ORTICARIA CRONICA
- Comparsa da oltre le 6 settimane
- Etiologia sconosciuta nell’80-90% dei casi, per questo spesso considerata idiopatica
- Colpisce più spesso gli adulti e di sesso femminile.
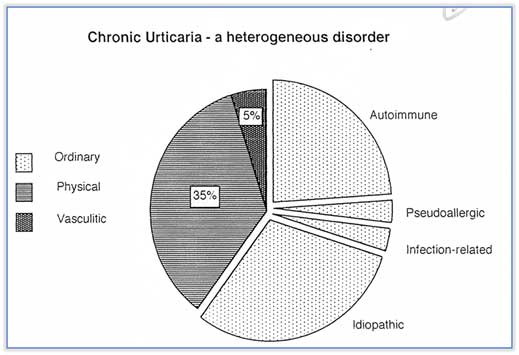
Clive E. H. Grattan J Am Acad Dermatol 2002; 16: 645-57
PATOGENESI DELL’ORTICARIA
-
Il ruolo centrale è svolto dai mastociti e dai mediatori vasoattivi in essi contenuti, in particolare dall’istamina.
-
Mediatori mastocitari implicati nella patogenesi dell’orticaria:
- Mediatori preformati, contenuti nei granuli dei mastociti (istamina, serotonina, triptasi, chinasi, carbossipeptidasi, fattori chemiotattici per i neutrofili e per gli eosinofili).
- Metaboliti sintetizzati al momento della degranulazione dei mastociti, quando la membrana cellulare viene attivata da stimoli specifici, quali: leucotrieni e prostaglandine.
- Citochine preformate e neoformate: IL-1, IL-3, IL-4, IL-5, IL-6, TNFα, IFNγ,
GM-CSF.
Dei mediatori mastocitari implicati nella patogenesi dell’orticaria l’Istamina, è il principale mediatore vasoattivo.
- Il pomfo è il risultato della vasodilatazione e dell’aumento della permeabilità vasale indotta direttamente dall’istamina attraverso i recettori H1 ed in minor misura dai recettori H2, presenti sui vasi cutanei.
- I recettori H1 attivati stimolano le terminazioni nervose sensitive, quindi: prurito e liberazione di sostanza P.
- La sostanza P causa ulteriore vasodilatazione che clinicamente causa l’alone eritematoso
- Triptasi e chinasi (mediatori preformati presenti nei mastociti) inducono attivazione del complemento e scindono il C3 in (C3a e C3b).
- Il C3a è una anafilotossina che, legandosi alla membrana dei mastociti, ne stimola ulteriore degranulazione.
Istologia dell’orticaria
Orticaria acuta:
- Edema del derma interstiziale, dilatazione dei vasi linfatici e venosi
- Edema delle cellule endoteliali
- Scarso infiltrato infiammatorio (granulociti eosinofili a disposizione perivascolare).
Orticaria cronica:
- Edema del derma interstiziale più cospicuo rispetto a quello dell’orticaria acuta
- Intenso infiltrato infiammatorio costituito da granulociti neutrofili, eosinofili
e linfociti.
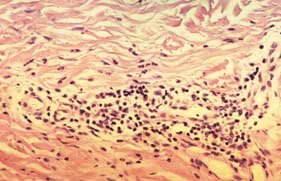
Biopsia orticaria acuta
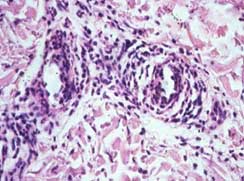
Biopsia vasculite cronica
Diagnosi di orticaria
La diagnosi è clinica!
Gli eventuali esami di approfondimento devono essere consigliati in base ad una attenta raccolta anamanestica (anamnesi familiare, sintomi sistemici, assunzione di cibi urticanti o allergizzanti, farmaci, punture di imenoteri, etc.).
- Oltre ad i test allergometrici mirati, il test con siero e/o plasma autologo nelle forme autoimmuni e/o ai tests per orticaria da agenti fisici;
- Possono essere richiesti se necessari, esami di laboratorio: Emocromo con formula, PCR, VES, Marker epatite B e C, Urinocoltura, Esame parassitologico delle feci, Elettroforesi proteica, Immunoglobuline, C3, C4, C1 inibitore, Autoanticorpi sistemici e organospecifici, includendo i valori degli autoanticorpi antitiroide (antimicrosomiali, antitireoglobulina), LDH, Crioglobuline, Eventuale biopsia cutanea della lesione.
Terapia dell’orticaria e dell’angioedema
- La terapia dell’orticaria, sia acuta che cronica e dell’angioedema dovrebbe essere diretta ad eliminare i fattori scatenanti specifici, se suggerita dalla storia e dalla diagnostica mirata.
- L’uso di antistaminici, sono una terapia di prima linea per la persistenza dei sintomi, con dosi terapeutiche per il singolo paziente che massimizza il controllo dei sintomi, con effetti collaterali tollerabili.
- Gli Antistaminici non sedativi chiamati anche di “seconda generazione”, (Cetirizina, Fexofenadina, Ebastina, Desloratadina, Rupatadina, Bilastina) sono stati progettati tramite modifiche chimiche che ne limitano il passaggio attraverso la barriera emato-encefalica, possono indurre minimi effetti sedativi, a fronte degli antistaminici di “prima generazione”, quali l’idrossizina e difenidramina, che comunemente inducono sedazione ed effetti anticolinergici.
- Gli antistaminici di seconda generazione hanno dimostrato l’efficacia e la sicurezza a lungo termine (anche per bambini piccoli) nell’orticaria acuta, se usati su base regolare e titolati a una dose efficace nella maggior parte dei pazienti.
- Altre terapie dirette verso i recettori istaminici (doxepina), H2 bloccanti (ad esempio, ranitidina), o una combinazione di antagonisti dei recettori H1 e H2 dell’istamina, possono essere considerati come ulteriori opzioni terapeutiche per l’orticaria acuta.
- La terapia diretta verso altri mediatori di orticaria e angioedema (ad esempio, i leucotrieni) possono essere bersaglio di antagonisti dei leucotrieni come il montelukast, tuttavia, meta-analisi di diversi studi non ha dimostrato benefici convincenti.
- Un breve ciclo di corticosteroidi per via orale può essere considerato, se i sintomi sono gravi o non risolvibili con gli antistaminici.
- Studi sugli adulti hanno dimostrato che i tempi di risoluzione di una orticaria acuta è diminuita con l’aggiunta di corticosteroidi per via orale agli antistaminici.
- A livello pediatrico la dose-effetti collaterali di corticosteroidi orali, come la soppressione surrenale e gli effetti sulla crescita o la mineralizzazione delle ossa, di solito non sono un problema per uso a breve termine (meno di 2 settimane).
Nell’orticaria cronica,
- il primo step, è l’utilizzo di antistaminici di seconda generazione a dosaggi ottimizzati.
- Il secondo step, prevede nei soggetti non responders, l’utilizzo associato agli antistaminici, di Corticosteroidi sistemici:
- Trattamento con prednisone 0,3-0,5 mg/kg/die o metilprednisolone 16 mg/die per 1-2 settimane, con riduzione graduale della posologia.
- Il trattamento con steroide è in genere efficace, ma l’uso prolungato espone il paziente a seri effetti collaterali (ipertensione arteriosa, diabete meta-steroideo, osteoporosi..).
- Il terzo step, prevede nei soggetti non responders, l’utilizzo di agenti più potenti antinfiammatori o immunosoppressori (ad esempio, la Ciclosporina A alla dose di
3-5 mg/Kg/die), antistaminici di seconda generazione, i corticosteroidi sistemici a base dosi o se possibile sospesi.
- Studi controllati in doppio cieco hanno dimostrato l’efficacia della ciclosporina nell’orticaria cronica (autoimmune e non) (Fradin, J Am Acad Dermatol 1991; Barlow, Eur J Dermatol 1993; Toubi, Allergy 1997; Grattan, Br J Dermatol 2000;).
- Il trattamento dura di solito 3-6 mesi e richiede un attento controllo clinico e dei parametri di laboratorio (funzionalità renale; epatica, PA, etc.).
- Il quarto step, stesso approccio vale per l’Omalizumab, farmaco anti IgE, nei soggetti non responders, in alternativa ala Ciclosporina, che ha dimostrato una buona efficacia in soggetti con orticaria cronica grave, spontanea, allergica, colinergica, da freddo, solare, ma è previsto l’utilizzo solo in ambulatori situati presso strutture di ricovero.
Conclusioni
Un approccio razionale alla diagnosi e terapia dell’orticaria e angioedema devono essere adottate dai medici, nonostante il fatto che in molti casi, la causa specifica della malattia può non essere evidente o confermata dai tests allergometrici o dalle prove di laboratorio. Alcune considerazioni di carattere generale, vanno sempre fatte come ad esempio se l’orticaria e/o angioedema è acuta o cronica, allergica o non allergica, o associata ad altre malattie autoimmuni sistemiche, tutto questo può aiutare a formulare la diagnosi e orientare la terapia in modo efficace e corretta.
Bibliografia
- The diagnosis and management of urticaria: a practice parameter part I: acute urticaria/angioedema part II: chronic urticaria/angioedema. Joint Task Force on Practice Parameters. Ann Allergy Asthma Immunol. 2000 Dec;85(6 Pt 2):521–44.
- Bailey E, Shaker M. An update on childhood urticaria and angioedema. Curr Opin Pediatr. 2008 Aug;20(4):425–30.
- Yates C. Parameters for the treatment of urticaria and angioedema. J Am Acad Nurse Pract. 2002 Nov;14(11):478–83.
- Cribier B. Urticaria and hepatitis. Clin Rev Allergy Immunol. 2006 Feb;30(1):25–9.
- Liu TH, Lin YR, Yang KC, et al. First attack of acute urticaria in pediatric emergency department. Pediatr Neonatol. 2008 Jun;49(3):58–64.
- Novembre E, Cianferoni A, Mori F, et al. Urticaria and urticaria related skin condition/disease in children. Eur Ann Allergy Clin Immunol. 2008 May;40(1):5–13.
- Pruksachatkunakorn C, Apichartpiyakul N, Kanjanaratanakorn K. Parvovirus B19 infection in children with acute illness and rash. Pediatr Dermatol. 2006 May-Jun;23(3):216–8.
- Sackesen C, Sekerel BE, Orhan F, et al. The etiology of different forms of urticaria in childhood. Pediatr Dermatol. 2004 Mar-Apr;21(2):102–8.
- Sakurai M, Oba M, Matsumoto K, et al. Acute infectious urticaria: clinical and laboratory analysis in nineteen patients. J Dermatol. 2000 Feb;27(2):87–93.
- Shah KN, Honig PJ, Yan AC. “Urticaria multiforme”: a case series and review of acute annular urticarial hypersensitivity syndromes in children. 2007 May;119(5):e1177–83.
- Simons FE. Prevention of acute urticaria in young children with atopic dermatitis. J Allergy Clin Immunol. 2001 Apr;107(4):703–6.
- The diagnosis and management of anaphylaxis: an updated practice parameter. J Allergy Clin Immunol. 2005 Mar;115(3 Suppl 2):S483–523.
- Burks W. Skin manifestations of food allergy. 2003 Jun;111(6 Pt 3):1617–24.
- Sicherer SH, Leung DY. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects. J Allergy Clin Immunol. 2006 Jul;118(1):170–7.
- Mathelier-Fusade P. Drug-induced urticarias. Clin Rev Allergy Immunol. 2006 Feb; 30(1):19–23.
- Kemp SF, Lockey RF, Simons FE. Epinephrine: the drug of choice for anaphylaxis. A statement of the World Allergy Organization. Allergy. 2008 Aug;63(8):1061–70.
- Zuberbier T, Maurer M. Urticaria: current opinions about etiology, diagnosis and therapy. Acta Derm Venereol. 2007;87(3):196–205.
- Chong SU, Worm M, Zuberbier T. Role of adverse reactions to food in urticaria and exercise-induced anaphylaxis. Int Arch Allergy Immunol. 2002 Sep;129(1):19–26.
- Guin JD. Clinical presentations of patients sensitive to natural rubber latex. 2004 Dec;15(4):192–6.
- Jeebhay MF, Robins TG, Lehrer SB, et al. Occupational seafood allergy: a review. Occup Environ Med. 2001 Sep;58(9):553–62.
- Guly HR, Grant IC. Case of the month: Lesson of the week: don’t forget scombroid. Emerg Med J. 2006 Dec;23(12):955–6.
- Chegini S, Metcalfe DD. Contemporary issues in food allergy: seafood toxin-induced disease in the differential diagnosis of allergic reactions. Allergy Asthma Proc. 2005 May-Jun;26(3):183–90.
- Perkins RA, Morgan SS. Poisoning, envenomation, and trauma from marine creatures. Am Fam Physician. 2004 Feb 15;69(4):885–90.
- Perteguer MJ, Chivato T, Montoro A, et al. Specific and total IgE in patients with recurrent, acute urticaria caused by Anisakis simplex. Ann Trop Med Parasitol. 2000 Apr;94(3):259–68.
- Anliker MD, Wuthrich B. Acute urticaria and angioedema due to ehrlichiosis. 2003;207(4):417–8.
- Frank MM, Jiang H. New therapies for hereditary angioedema: disease outlook changes dramatically. J Allergy Clin Immunol. 2008 Jan;121(1):272–80.
- Frank MM. 8. Hereditary angioedema. J Allergy Clin Immunol. 2008 Feb;121(2 Suppl):S398–401; quiz S19.
- Bernstein JA. Hereditary angioedema: a current state-of-the-art review, VIII: current status of emerging therapies. Ann Allergy Asthma Immunol. 2008 Jan;100(1 Suppl 2): S41–6.
- Temino VM, Peebles RS, Jr. The spectrum and treatment of angioedema. Am J Med. 2008 Apr;121(4):282–6.
- Zuraw BL. Hereditary angiodema: a current state-of-the-art review, IV: short- and longterm treatment of hereditary angioedema: out with the old and in with the new? Ann Allergy Asthma Immunol. 2008 Jan;100(1 Suppl 2):S13–8.
- Fietta P. Autoinflammatory diseases: the hereditary periodic fever syndromes. Acta Biomed. 2004 Aug;75(2):92–9.
- Sarrauste de Menthiere C, Terriere S, Pugnere D, et al. INFEVERS: the Registry for FMF and hereditary inflammatory disorders mutations. Nucleic Acids Res. 2003 Jan 1;31(1):282–5.
- Alonso R, Cistero-Bahima A, Enrique E, et al. Recurrent urticaria as a rare manifestation of familial Mediterranean fever. J Investig Allergol Clin Immunol. 2002;12(1):60–1.
- Hawkins PN, Lachmann HJ, Aganna E, et al. Spectrum of clinical features in Muckle- Wells syndrome and response to anakinra. Arthritis Rheum. 2004 Feb;50(2):607–12.
- Yancey KB, Hall RP, Lawley TJ. Pruritic urticarial papules and plaques of pregnancy. Clinical experience in twenty-five patients. J Am Acad Dermatol. 1984 Mar;10(3): 473–80.
- Su W, Hall BJt, Cockerell CJ. Photodermatitis with minimal inflammatory infiltrate: clinical inflammatory conditions with discordant histologic findings. Am J Dermatopathol. 2006 Dec;28(6):482–5.
- Burnett MM, Huang MS, Seliem RM. Case records of the Massachusetts General Hospital. Case 29–2007. Case 39–2007. A 5-month-old girl with skin lesions. N Engl J Med. 2007 Dec 20;357(25):2616–23.
- Caro I, Zembowicz A. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 5–2003 – a 16-year-old girl with a rash and chest pain. N Engl J Med. 2003 Feb 13;348(7):630–7.
- Prendiville JS, Tucker LB, Cabral DA, et al. A pruritic linear urticarial rash, fever, and systemic inflammatory disease in five adolescents: adult-onset still disease or systemic juvenile idiopathic arthritis sine arthritis? Pediatr Dermatol. 2004 Sep-Oct;21(5):580–8.
- Hill A, Metry D. Urticarial lesions in a child with acute lymphoblastic leukemia and eosinophilia. Pediatr Dermatol. 2003 Nov-Dec;20(6):502–5.
- Reese I, Zuberbier T, Bunselmeyer B, et al. Diagnostic approach for suspected pseudoallergic reaction to food ingredients. J Dtsch Dermatol Ges. 2009 Jan;7(1):70–7.
- Eda A, Sugai K, Shioya H, et al. Acute allergic reaction due to milk proteins contaminating lactose added to corticosteroid for injection. Allergol Int. 2009 Mar;58(1):137–9.
- Dreyfus DH, Fraser B, Randolph CC. Anaphylaxis to latex in patients without identified risk factors for latex allergy. Conn Med. 2004 Apr;68(4):217–22.
- Usmani N, Wilkinson SM. Allergic skin disease: investigation of both immediate- and delayed-type hypersensitivity is essential. Clin Exp Allergy. 2007 Oct;37(10):1541–6.
- Bourrain JL. Occupational contact urticaria. Clin Rev Allergy Immunol. 2006 Feb;30(1):39–46.
- Escribano L, Akin C, Castells M, et al. Mastocytosis: current concepts in diagnosis and treatment. Ann Hematol. 2002 Dec;81(12):677–90.
- Guldbakke KK, Khachemoune A. Etiology, classification, and treatment of urticaria. 2007 Jan;79(1):41–9.
- Nielsen EW, Gramstad S. Angioedema from angiotensin-converting enzyme (ACE) inhibitor treated with complement 1 (C1) inhibitor concentrate. Acta Anaesthesiol Scand. 2006 Jan;50(1):120–2.
- Lin RY, Cannon AG, Teitel AD. Pattern of hospitalizations for angioedema in New York between 1990 and 2003. Ann Allergy Asthma Immunol. 2005 Aug;95(2):159–66.
- Cousin F, Philips K, Favier B, et al. Drug-induced urticaria. Eur J Dermatol. 2001 May-Jun;11(3):181–7.
- Diaz Jara M, Perez Montero A, Gracia Bara MT, et al. Allergic reactions due to ibuprofen in children. Pediatr Dermatol. 2001 Jan-Feb;18(1):66–7.
- Grattan CE. Aspirin sensitivity and urticaria. Clin Exp Dermatol. 2003 Mar;28(2):123–7.
- Loo WJ, Alexandroff A, Flanagan N. Bupropion and generalized acute urticaria: a further case. Br J Dermatol. 2003 Sep;149(3):660.
- Sabra A, Bellanti JA, Rais JM, et al. IgE and non-IgE food allergy. Ann Allergy Asthma Immunol. 2003 Jun;90(6 Suppl 3):71–6.
- Szczeklik A, Sanak M. The broken balance in aspirin hypersensitivity. Eur J Pharmacol. 2006 Mar 8;533(1–3):145–55.
- Finkle WD, Adams JL, Greenland S, et al. Increased risk of serious injury following an initial prescription for diphenhydramine. Ann Allergy Asthma Immunol. 2002 Sep;89(3):244–50.
- Milgrom H, Bender B, Wamboldt F. Of injuries and antihistamines and dosing. Ann Allergy Asthma Immunol. 2002 Sep;89(3):221–3.
- Bender BG, McCormick DR, Milgrom H. Children’s school performance is not impaired by short-term administration of diphenhydramine or loratadine. J Pediatr. 2001 May;138(5):656–60.
- Bender B, Milgrom H. Neuropsychiatric effects of medications for allergic diseases. J Allergy Clin Immunol. 1995 Feb;95(2):523–8.
- Robb G, Sultana S, Ameratunga S, et al. A systematic review of epidemiological studies investigating risk factors for work-related road traffic crashes and injuries. Inj Prev. 2008 Feb;14(1):51–8.
- Tashiro M, Sakurada Y, Mochizuki H, et al. Effects of a sedative antihistamine, D-chlorpheniramine, on regional cerebral perfusion and performance during simulated car driving. Hum Psychopharmacol. 2008 Mar;23(2):139–50.
- Vuurman E, Theunissen E, van Oers A, et al. Lack of effects between rupatadine 10 mg and placebo on actual driving performance of healthy volunteers. Hum Psychopharmacol. 2007 Jul;22(5):289–97.
- Jauregui I, Mullol J, Bartra J, et al. H1 antihistamines: psychomotor performance and driving. J Investig Allergol Clin Immunol. 2006;16 Suppl 1:37–44.
- Theunissen EL, Vermeeren A, Vuurman EF, et al. Stimulating effects of H1-antagonists. Curr Pharm Des. 2006;12(20):2501–9.
- Theunissen EL, Vermeeren A, Ramaekers JG. Repeated-dose effects of mequitazine, cetirizine and dexchlorpheniramine on driving and psychomotor performance. Br J Clin Pharmacol. 2006 Jan;61(1):79–86.
- Tashiro M, Horikawa E, Mochizuki H, et al. Effects of fexofenadine and hydroxyzine on brake reaction time during car-driving with cellular phone use. Hum Psychopharmacol. 2005 Oct;20(7):501–9.
- Verster JC, Volkerts ER. Antihistamines and driving ability: evidence from on-theroad driving studies during normal traffic. Ann Allergy Asthma Immunol. 2004 Mar;92(3):294–303; quiz -5, 55.
- Vuurman EF, Rikken GH, Muntjewerff ND, et al. Effects of desloratadine, diphenhydramine, and placebo on driving performance and psychomotor performance measurements. Eur J Clin Pharmacol. 2004 Jul;60(5):307–13.
- Portnoy JM, Simon SD. Is 3-mm less drowsiness important? Ann Allergy Asthma Immunol. 2003 Oct;91(4):324–5.
- Potter PC, Schepers JM, Van Niekerk CH. The effects of fexofenadine on reaction time, decision-making, and driver behavior. Ann Allergy Asthma Immunol. 2003 Aug;91(2):177–81.
- Ridout F, Shamsi Z, Meadows R, et al. A single-center, randomized, double-blind, placebo-controlled, crossover investigation of the effects of fexofenadine hydrochloride 180 mg alone and with alcohol, with hydroxyzine hydrochloride 50 mg as a positive internal control, on aspects of cognitive and psychomotor function related to driving a car. Clin Ther. 2003 May;25(5):1518–38.
- Verster JC, de Weert AM, Bijtjes SI, et al. Driving ability after acute and sub-chronic administration of levocetirizine and diphenhydramine: a randomized, double-blind, placebo-controlled trial. Psychopharmacology (Berl). 2003 Aug;169(1):84–90.
- Welch MJ, Meltzer EO, Simons FE. H1-antihistamines and the central nervous system. Clin Allergy Immunol. 2002;17:337–88.
- Vermeeren A, Ramaekers JG, O’Hanlon JF. Effects of emedastine and cetirizine, alone and with alcohol, on actual driving of males and females. J Psychopharmacol. 2002 Mar;16(1):57–64.
- Kay GG, Quig ME. Impact of sedating antihistamines on safety and productivity. Allergy Asthma Proc. 2001 Sep-Oct;22(5):281–3.
- Lee TH, Dudley J, Demonaco HJ. Drug effects on driving performance. Ann Intern Med. 2000 Oct 17;133(8):656–7; author reply 7–8.
- Ramaekers JG, Vermeeren A. All antihistamines cross blood-brain barrier. 2000 Sep 2;321(7260):572.
- Antihistamines and driving-related behavior: A review of the evidence for impairment. Ann Emerg Med. 2000 Oct;36(4):388–9.
- Hennessy S, Strom BL. Nonsedating antihistamines should be preferred over sedating antihistamines in patients who drive. Ann Intern Med. 2000 Mar 7;132(5):405–7.
- Weiler JM, Bloomfield JR, Woodworth GG, et al. Effects of fexofenadine, diphenhydramine, and alcohol on driving performance. A randomized, placebo-controlled trial in the Iowa driving simulator. Ann Intern Med. 2000 Mar 7;132(5):354–63.
- Black AK, Greaves MW. Antihistamines in urticaria and angioedema. Clin Allergy Immunol. 2002;17:249–86.
- Howarth PH. Assessment of antihistamine efficacy and potency. Clin Exp Allergy. 1999 Jul;29 Suppl 3:87–97.
- Prenner BM. The evolution of pharmacotherapy for rhinitis and urticaria. Allergy Asthma Proc. 2001 Sep-Oct;22(5):277–80.
- Lee EE, Maibach HI. Treatment of urticaria. An evidence-based evaluation of antihistamines. Am J Clin Dermatol. 2001;2(1):27–32.
- Poon M, Reid C. Do steroids help children with acute urticaria? Arch Dis Child. 2004 Jan;89(1):85–6.
- Pollack CV, Jr., Romano TJ. Outpatient management of acute urticaria: the role of prednisone. Ann Emerg Med. 1995 Nov;26(5):547–51.
- Zuberbier T, Ifflander J, Semmler C, et al. Acute urticaria: clinical aspects and therapeutic responsiveness. Acta Derm Venereol. 1996 Jul;76(4):295–7.
- Zuberbier T, Greaves MW, Juhlin L, et al. Management of urticaria: a consensus report. J Investig Dermatol Symp Proc. 2001 Nov;6(2):128–31.
- Beno SM, Nadel FM, Alessandrini EA. A survey of emergency department management of acute urticaria in children. Pediatr Emerg Care. 2007 Dec;23(12):862–8.
- McBayne TO, Siddall OM. Montelukast treatment of urticaria. Ann Pharmacother. 2006 May;40(5):939–42.
- Fujii K, Konishi K, Kanno Y, et al. Acute urticaria with elevated circulating interleukin-6 is resistant to anti-histamine treatment. J Dermatol. 2001 May;28(5):248–50.
- Kubota Y, Koga T, Nakayama J. In vitro released interferon-gamma in the diagnosis of drug-induced anaphylaxis. Eur J Dermatol. 1999 Oct-Nov;9(7):559–60.
- Metz M, Grimbaldeston MA, Nakae S, et al. Mast cells in the promotion and limitation of chronic inflammation. Immunol Rev. 2007 Jun;217:304–28.
- Metz M, Piliponsky AM, Chen CC, et al. Mast cells can enhance resistance to snake and honeybee venoms. 2006 Jul 28;313(5786):526–30.
- Metz M, Siebenhaar F, Maurer M. Mast cell functions in the innate skin immune system. 2008;213(3–4):251–60.
- Siebenhaar F, Magerl M, Peters EM, et al. Mast cell-driven skin inflammation is impaired in the absence of sensory nerves. J Allergy Clin Immunol. 2008 Apr;121(4):955–61.
- Sokol CL, Barton GM, Farr AG, et al. A mechanism for the initiation of allergen-induced T helper type 2 responses. Nat Immunol. 2008 Mar;9(3):310–8.